Лечение ПВИ
Лечение папилломовирусной инфекции, как и большинства заболеваний, обусловленных персистенцией возбудителя в организме, имеет свои трудности.
Согласно с общепринятыми стандартами лечения ПВИ пораженные клетки должны быть удалены с помощью деструктивных методов (криодеструкции, лазервапоризации, электро- или радиоволнового лечения). Однако использование местной терапии в качестве единственого метода лечения приводит к рецидивам предопухолевых заболеваний, частота которых достигает 30-65%, что в свою очередь связано с сохранением этиологического фактора - ВПЧ. Учитывая это, все местные методы лечения должны сочетаться с этиопатогенетической терапией.
 На сегодняшний день препаратов, которые имеют специфическое противовирусное действие на ВПЧ не существует. Наиболее часто для лечения ПВИ используют интерфероны и разные иммуномодуляторы.
На сегодняшний день препаратов, которые имеют специфическое противовирусное действие на ВПЧ не существует. Наиболее часто для лечения ПВИ используют интерфероны и разные иммуномодуляторы.
Из клинической практики известно, что один из способов терапии ВПЧ-ассоциированных заболеваний – это вагинальные суппозитории, содержащие интерферон-2. Известно также, что примерно в 40% случаев даже длительное назначение интерферона не приводит к клиническим улучшениям.
Феномен резистентности ВПЧ-инфицированных клеток к действию интерферона исследовался детально М. Nees и соавторами (2001). Оказалось, что это явление напрямую зависело от уровня синтеза онкобелка Е7.
Лечение поражений шейки матки, вызванных ВПЧ, включает: электрокоагуляцию, криотерапию, лазерную терапию, электрохирургическое вмешательство. Наряду с местным лечением и удалением очагов поражения необходимо проведение длительных курсов антивирусной и иммуномодулирующей терапии, т.к. формирование дисплазий и эрозий является прогностическим признаком возможной малигнизации клеток в очагах поражения и развития рака. Поэтому после удаления дисплазий и эрозий необходимо длительное применение вагинальных свечей с иммуномодулирующими и противовирусными препаратами.
Из клинической практики известно, что один из способов терапии ВПЧ-ассоциированных заболеваний – это вагинальные суппозитории, содержащие интерферон-2. Известно также, что примерно в 40% случаев даже длительное назначение интерферона не приводит к клиническим улучшениям.
Феномен резистентности ВПЧ-инфицированных клеток к действию интерферона исследовался недавно более детально М. Nees и соавторами (2001). Оказалось, что это явление напрямую зависело от уровня синтеза онкобелка Е7. Авторы установили, что белок Е7 нейтрализует противовирусную и противоопухолевую активность интерферона -2 за счет того, что он способен избирательно блокировать большинство генов, индуцируемых интерфероном, сводя на нет все усилия интерферонотерапии.
Другая группа авторов обнаружила способность онкобелка Е7 внутриклеточно инактивировать IRF (interferon regulatory factor – фактор регуляции активности интерферона). IRF является внутриклеточным фактором транскрипции, который активируется в клетках при действии на них интерферона - и -. IRF «включает» транскрипцию генов, которые кодируют синтез противовирусных белков.
Большинство современных режимов лечения дисплазий шейки матки базируются на деструкции пораженного эпителия с помощью иссечения электрохирургическим путем или проведением лазеро-вапоризации, криодеструкции или радиохирургического иссечения. Однако, более чем у половины больных, которым проведено только деструктивное лечение, возникают рецидивы заболевания, которые тяжело поддаются лечению.
Широко используемыми в последние годы для лечения дисплазий шейки матки являются интерфероны (ИФ) и их индукторы. При лечении дисплазий шейки матки, ассоциированных с вирусными инфекциями применяют схемы местного (внутриочагового) лечения и системного введения рекомбинантных интерферонов (лаферон, роферон-А, интрон) от 1 млн. до 4 млн. в сутки.
Местно рекомендуется введение индукторов интерферонов в виде аппликаций (линимент циклоферона 5%), свечей (реаферои, виферон, тиотриазолин) или внутрикондиломно (альфа- и бета-интерферон).
Для профилактики злокачественных образований необходимо регулярное посещение врача с целью выявления и своевременного лечения дисплазии половых органов.
Не лишним будет отказ от вредных привычек и сбалансированное питание, которые способствуют укреплению иммунной системы организма.
Будьте здоровы!


 Существует множество форм вирусных гепатитов: от легких, субклинических, до тяжелых, быстропрогрессирующих; от острых до хронических поражений с развитием цирроза и рака печени.
Существует множество форм вирусных гепатитов: от легких, субклинических, до тяжелых, быстропрогрессирующих; от острых до хронических поражений с развитием цирроза и рака печени.




 Заражение гепатитами, передающимися через кровь, происходит при контакте с кровью больного. Реже инфицирование происходит половым путем и во время беременности или родов (в этом случае страдает плод). Повышается риск заражения при проведении операций, переливании крови, использовании препаратов крови для лечения различных заболеваний (например, гемофилия); посещении стоматолога; наркомании; а также при таких манипуляциях как маникюр, татуаж, пирсинг.
Заражение гепатитами, передающимися через кровь, происходит при контакте с кровью больного. Реже инфицирование происходит половым путем и во время беременности или родов (в этом случае страдает плод). Повышается риск заражения при проведении операций, переливании крови, использовании препаратов крови для лечения различных заболеваний (например, гемофилия); посещении стоматолога; наркомании; а также при таких манипуляциях как маникюр, татуаж, пирсинг.
 В таких случаях нельзя обойтись без лабораторного подтверждения герпевирусной инфекции.
В таких случаях нельзя обойтись без лабораторного подтверждения герпевирусной инфекции.
 Врачами разработаны этапы противовирусной терапии, позволяющие достичь длительной ремиссии (отсутствие клинических проявлений болезни).
Врачами разработаны этапы противовирусной терапии, позволяющие достичь длительной ремиссии (отсутствие клинических проявлений болезни).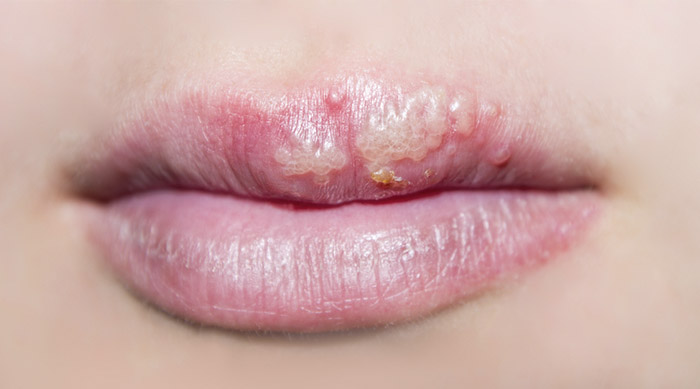
 Как же связаны между собой иммунитет и герпесвирусная инфекция? Вирус – одна из наиболее древних форм материи, которая не может существовать самостоятельно – для размножения ей необходимы живые клетки. При поражении клетки вирус встраивается в ее генный аппарат, изменяя его таким образом, что клетка вместо того, чтобы вырабатывать собственные белки, необходимые ей для жизнедеятельности, начинает воспроизводить вирусы, которые в свою очередь поражают другие здоровые клетки. В процессе эволюции организм человека приспособился к сосуществованию с вирусами, которые являются для него антигенами, т.е. чужеродными агентами. Нормально функционирующая иммунная система способна распознавать антигены и уничтожать их.
Как же связаны между собой иммунитет и герпесвирусная инфекция? Вирус – одна из наиболее древних форм материи, которая не может существовать самостоятельно – для размножения ей необходимы живые клетки. При поражении клетки вирус встраивается в ее генный аппарат, изменяя его таким образом, что клетка вместо того, чтобы вырабатывать собственные белки, необходимые ей для жизнедеятельности, начинает воспроизводить вирусы, которые в свою очередь поражают другие здоровые клетки. В процессе эволюции организм человека приспособился к сосуществованию с вирусами, которые являются для него антигенами, т.е. чужеродными агентами. Нормально функционирующая иммунная система способна распознавать антигены и уничтожать их.
 Название цитомегаловирус происходит от древнегреческого языка (cyto - клетка, megal - большой). Этот вирус является одним из разновидностей семейства Herpesviridae. Цитомегаловирус поражает слюнные железы организма человека и персистирует в нем в течение всей жизни. Около 40 % населения нашей планеты являются носителями этой инфекции, а в странах с низким экономическим развитием данная цифра может достигать 100 %. При этом человек может и не догадываться о возможности инфицирования. Путями передачи цитомегаловирусной инфекции является воздушно - капельный, контактный, гематогенный (через кровь) и половой. Однако для передачи возбудителя требуется длительный тесный контакт с человеком, который является носителем инфекции. Первичными проявлениями инфицирования может быть клиника острого респираторного вирусного заболевания с последующим развитием пневмонии, также возможен мононуклеозоподобный синдром с легким гепатитом (поражение печени).
Название цитомегаловирус происходит от древнегреческого языка (cyto - клетка, megal - большой). Этот вирус является одним из разновидностей семейства Herpesviridae. Цитомегаловирус поражает слюнные железы организма человека и персистирует в нем в течение всей жизни. Около 40 % населения нашей планеты являются носителями этой инфекции, а в странах с низким экономическим развитием данная цифра может достигать 100 %. При этом человек может и не догадываться о возможности инфицирования. Путями передачи цитомегаловирусной инфекции является воздушно - капельный, контактный, гематогенный (через кровь) и половой. Однако для передачи возбудителя требуется длительный тесный контакт с человеком, который является носителем инфекции. Первичными проявлениями инфицирования может быть клиника острого респираторного вирусного заболевания с последующим развитием пневмонии, также возможен мононуклеозоподобный синдром с легким гепатитом (поражение печени).
